Doktorarbeit von Michael Kastenberger
1 Einleitung
1.1 Otto Heinrich Warburg: Eine historische Einführung
Der Chemiker, Arzt und Physiologe Otto Heinrich Warburg (Abb. 1.1) wurde am 8. Oktober 1888 in Freiburg i. Br. geboren und zählt mit zu den wichtigsten Köpfen der Biochemie im 20. Jahrhundert.
Er studierte Chemie in Freiburg und Berlin und setzte seine Ausbildung mit einem Medizinstudium in Berlin, München und Heidelberg fort. 1914 wurde Otto Heinrich Warburg zum Mitglied der Kaiser-Wilhelm-Gesellschaft ernannt. 3 Jahre später wurde er zum Professor an der Friedrich-Wilhelms-Universität Berlin berufen. 1930 gründete Warburg das Kaiser-Wilhelm-Institut für Zellphysiologie und blieb dort Direktor bis 1967. In seinen Forschungen widmete er sich der Photosynthese, der Krebsforschung und der biologischen Energieübertragung. Mit der Entdeckung der Cytochromoxidase entschlüsselte er 1926 den Mechanismus der Zellatmung und erhielt dafür 1931 den Nobelpreis für Medizin und Physiologie. Ein weiterer Meilenstein in Warburgs Forschung waren seine Arbeiten und Publikationen zum Stoffwechsel von Tumoren [121]. Dabei entdeckte er, dass Tumore ungewöhnlich hohe Mengen an Laktat sezernieren. Diese Beobachtung erklärte sich Warburg 1930 mit der sogenannten „Warburg-Hypothese“, die besagt, dass Tumorzellen ihre Energie primär durch Umwandlung von Pyruvat zu Laktat gewinnen und nicht durch Oxidation mit Hilfe von Sauerstoff. Da die Tumorzellen diese Art der Energiegewinnung auch in Anwesenheit von Sauerstoff nutzen, wird dieses Phänomen auch als „aerobe Glykolyse“ bezeichnet. Als Ursache für seine Hypothese postulierte Warburg eine gestörte Funktion der Mitochondrien in Tumorzellen, was für ihn auch die grundlegende Ursache von Krebs war (Abb. 1.2).
1 Einleitung
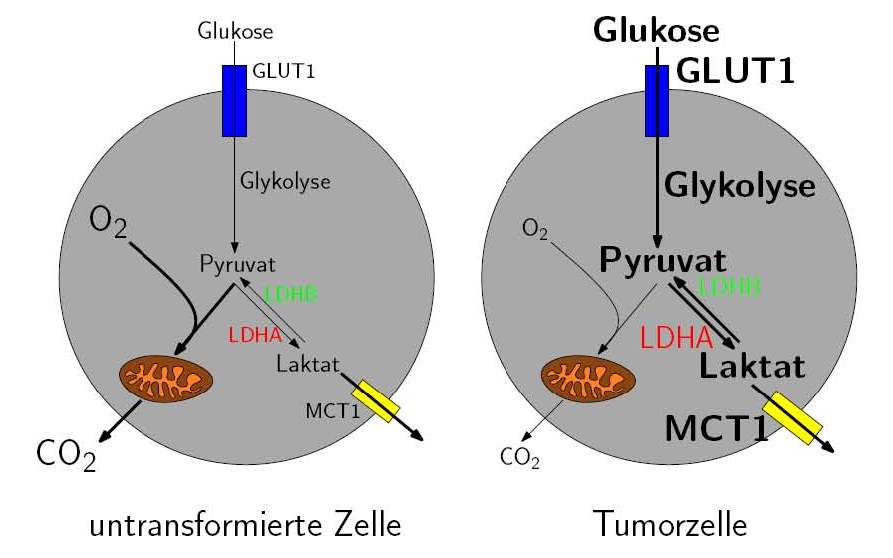 Abbildung 1.2: Der Warburg-Phänotyp: Aerobe Glykolyse in Tumorzellen. Nach Aufnahme über den Glukosetransporter GLUT1 wird die Glukose in der Glykolyse zu Pyruvat verstoffwechselt. In untransformierten Zellen wird Pyruvat in die Mitochondrien geschleust, wo es mit Hilfe von O2 in der oxidativen Phosphorylierung zur ATP-Synthese verwendet wird. Tumorzellen generieren ATP überwiegend in der Glykolyse. Dabei enstehendes Laktat wird über den Monocarboxylattransporter MCT1 aus der Zelle ausgeschleust.
Abbildung 1.2: Der Warburg-Phänotyp: Aerobe Glykolyse in Tumorzellen. Nach Aufnahme über den Glukosetransporter GLUT1 wird die Glukose in der Glykolyse zu Pyruvat verstoffwechselt. In untransformierten Zellen wird Pyruvat in die Mitochondrien geschleust, wo es mit Hilfe von O2 in der oxidativen Phosphorylierung zur ATP-Synthese verwendet wird. Tumorzellen generieren ATP überwiegend in der Glykolyse. Dabei enstehendes Laktat wird über den Monocarboxylattransporter MCT1 aus der Zelle ausgeschleust.
1.2 Die „aerobe Glykolyse“ heute
Obwohl es nun schon ca. 80 Jahre zurück liegt, dass Otto Heinrich Warburg Veränderungen im Energiestoffwechsel von Tumoren feststellte, ist dieses Gebiet immer noch ein zentrales Thema wissenschaftlicher Studien und Diskussionen. Die Warburg-Hypothese ist dabei bis heute weder eindeutig bewiesen noch widerlegt worden. In den letzten Jahrzehnten erweckte das Thema erneut das Interesse der Öffentlichkeit durch zahlreiche Publikationen, die sich für und gegen dieWarburg-Hypothese aussprachen. Für die Hypothese spricht unter anderem eine Veröffentlichung von Schulz et al. [102]. Die Gruppe überexprimierte Frataxin, ein mitochondriales Protein, in Kolonkarzinomzellen. Die Tumorzellen zeigten daraufhin eine erhöhte Respirationsrate und ein erhöhtes mitochondriales Membranpotential. Hierdurch kam es zu verringerten Proliferationsraten in vitro und zu einer geringeren Fähigkeit zur Tumorbildung nach Injektion in Mäuse. Das heisst, eine Normalisierung der Respiration führt zu einer Normalisierung der Proliferation. Entsprechend zeigten Untersuchungen von Kiebish et al., dass die Cardiolipinstruktur in Mitochondrien der Gehirntumore von Mäusen eine andere Zusammensetzung im Vergleich zu entsprechenden untransformierten Zellen hatte, was …
Hier geht es zur gesamten Arbeit:
Analyse und Modulation des Tumormetabolismus in humanen Tumorzelllinien und Tumorgeweben

